Il ruolo e gli effetti extra scheletrici della vitamina D sono noti ormai da almeno un decennio. Nel 2023 è uscita un’interessante revisione relativa alla relazione fra questa sostanza e le basi molecolari delle patologie metaboliche e cardiovascolari. In particolare, il lavoro, peraltro a firma di ricercatori italiani, raccoglie dati e osservazioni provenienti dai numerosi studi epidemiologici e osservazionali relativi al rapporto fra vitamina D e citochine pro- e anti- infiammatorie che influenzano l’azione dell’insulina, il metabolismo lipidico e le funzioni del tessuto adiposo .
Eccone una sintesi ragionata, con i link alla bibliografia più importante e alcuni approfondimenti.
Vitamina D
- La vit. D è un pro-ormone liposolubile sintetizzato attraverso un fenomeno di fotolisi del precursore 7-deidrocolesterolo indotta dai raggi UV assimilabile dagli alimenti che ne sono ricchi [pesci grassi (25 microg/100 g), tuorlo dell’uovo, olio di fegato di merluzzo (210 microg/100g), alimenti fortificati]. Quando vi è un’adeguata esposizione alla luce solare, l’organismo è in grado di sintetizzare la vit. D per coprire i suoi fabbisogni. Se non si ha l’occasione o l’abitudine di esporsi regolarmente al sole, è necessario acquisire vit. D dagli alimenti.

Una volta acquisita o prodotta, la vit. D deve subire due reazioni di idrossilazione, la prima delle quali avviene nel fegato a cui arriva attraverso il circolo sanguigno, legata a una proteina di trasporto (vit D binding protein, DBP). Da questa prima idrossilazione deriva la 25-idrossivitamina D (25-OH-D) che, trasportata da DBP ai tubuli renali, subisce la seconda idrossilazione.Ne deriva 1,25 – diidrossivitamina D (1,25-(OH)2- D), cioè la forma attiva della vit. D.
Effetti scheletrici: agendo in sinergia con l’ormone paratiroideo (PTH), è responsabile della regolazione della calcemia, promuovendo il riassorbimento intestinale di calcio e contribuendo così a una mineralizzazione ossea adeguata.
Effetti extra-scheletrici: data la presenza in vari tessuti di recettori ed enzimi idrossilanti, la vit. D ha effetti pleiotropici, in particolare ormonali, antinfiammatori, antiapoptotici, antifibrotici, antiossidanti e immunomodulatori. Fra questi effetti, sono centrali e importanti, quelli sul metabolismo lipidico e glucidico, in particolare quelli sulla resistenza insulinica che si esplicano attraverso la riduzione dell’espressione di alcune citochine infiammatorie, come l’interleuchina-1 (IL-1) [1, 2, 3]
Vit. D e insulino-resistenza (IR)
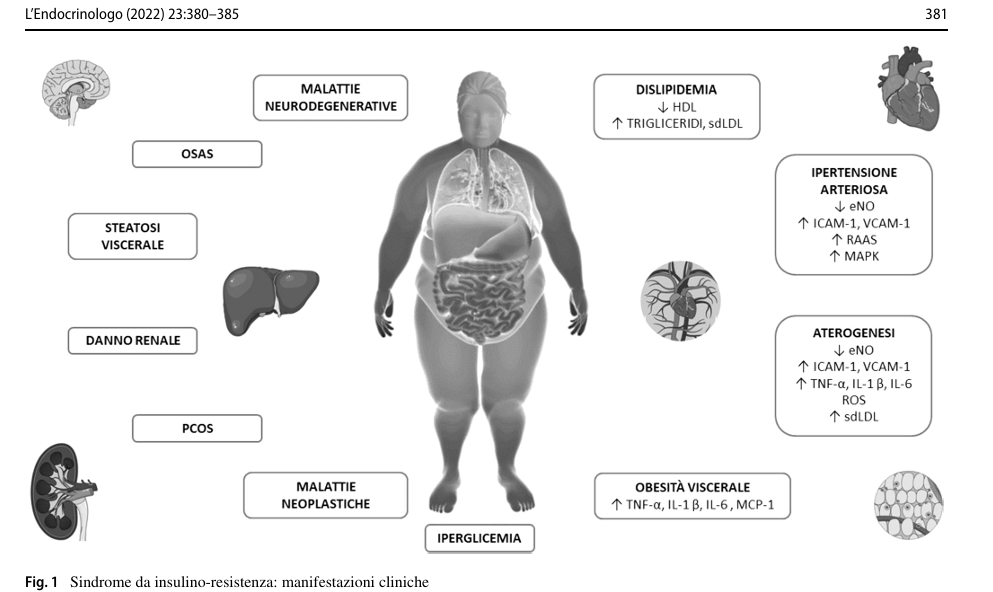
Fonte L’Endocrinologo (2022) 23:380–385 https://doi.org/10.1007/s40619-022-01131-3
L’insulino resistenza è una condizione basata sull’alterazione del processo di trasduzione del segnale dell’insulina, per cui concentrazioni di normali o aumentate dell’ormone producono un effetto biologico attenuato. L’IR si manifesta con un quadro clinico variabile, noto come sindrome da insulino-resistenza, che include alterazioni metaboliche, obesità viscerale, danno d’organo e associazione con altre patologie: sindrome dell’ovaio policistico, sindrome metabolica, sindrome delle apnee ostruttive del sonno, malattie neurodegenerative, persino patologie neoplastiche.
E’ stata dimostrata la relazione inversa fra la carenza di vit. D e l’indice HOMA-IR, utilizzato per quantificare la resistenza all’insulina e la funzione delle cellule beta del pancreas. Un’adeguata integrazione riduce l’IR e i livelli circolanti di insulina. La correlazione inversa fra HOMA-IR e IR diventa più forte con l’aumentare dell’Indice di Massa Corporea (IMC).
Al centro di questa relazione così importante (vit. D – RI) ci sono fondamentalmente tre fattori: 1) i recettori per l’insulina; 2) la produzione di citochine proinfiammatorie; 3) i polimorfismi dei recettori della vit. D (VDR) espressi a livello di beta-cellule pancreatiche.
- Recettori per l’isulina: la vit. D migliora la sensibilità insulinica aumentando l’espressione del recettore a livello muscolare, epatico e adiposo. Inoltre, promuove la conversione della proinsulina in insulina [4].
- Citochine proinfiammatorie: la carenza di vit. D aumenta l’espressione di citochine proinfiammatorie che, nei pazienti con IMC alto e molto alto, possono rappresentare la causa dell’IR. L’obesità, infatti, è associata all’ipovitaminosi D a causa di una minore esposizione alla luce solare comune in queste persone, di uno scarso apporto con l’alimentazione e per l’elevata secrezione di leptina (dal greco leptos = magro, è un ormone di natura proteica principalmente secreto dalle cellule del tessuto adiposo e rappresenta una componente fondamentale nel circuito omeostatico della regolazione del peso corporeo). Gli studi suggeriscono che alti dosaggi di vit. D possono ridurre i livelli circolanti di leptina e l’IR nei pazienti con obesità. Questo effetto sembra legato al legame della vit. D ai suoi recettori nel nucleo paraventricolare ipotalamico, regione che modula l’appetito e la sazietà [4].
- Recettori pancreatici VDR: la funzione della beta-cellule pancreatiche può essere influenzata direttamente dalla vit. D attraverso il suo legame con VDR che attiva la produzione di insulina. D’altra parte, la secrezione di insulina dipende strettamente anche dai livelli di calcio: la vit. D legandosi ai suoi recettori pancreatici sollecita l’ingresso di questo ione delle beta-cellule [4, 5, 6]
Vit. D e diabete mellito di tipo 2 (DMT2)
Il DMT2 è una patologia metabolica cronica caratterizzata da una inadeguata produzione di insulina e dal conseguente innalzamento dei livelli di glucosio ematici. Costituisce un fattore di rischio importante per patologie cardiovascolari e per complicanze come malattia retinica, ictus, infarto, insufficienza renale. In molti casi, la diagnosi di DMT2 è preceduta da una fase caratterizzata da livelli di glucosio nel sangue superiori alla norma, ma non così elevati da determinare un diabete conclamato e da elevati livelli di insulina circolante. In tutto il mondo moltissime persone presentano una condizione cosiddetta pre-diabetica senza esserne consapevoli: secondo l’OMS ne soffrono 762 milioni. La condizione di prediabete e quella di diabete conclamato sono strettamente connessi all’obesità (anche se in alcuni casi si può assistere a queste alterazioni metaboliche in persone normopeso o lievemente sovrappeso).
La carenza di vit. D è associata alla condizione di prediabete e alle complicanze micro e macrovascolari secondarie al DMT2.
Una recente metanalisi evidenzia come l’integrazione di vit. D aumenti la sensibilità all’insulina e migliori l’omeostasi glucidica, oltre che attraverso i meccanismi sopracitati, anche attraverso la modulazione dei livelli di paratormone e gli effetti di citochine antinfiammatorie [7].
In accordo con lo Studio prospettico sul diabete nel Regno Unito (UKPDS) i parametro d’elezione per valutare le modificazioni a lungo termine della glicemia è l’emoglobina glicata (HbA1c). Sia l’UKPDS che ulteriori importanti studi indicano come l’integrazione di vit. D possa ridurre i livelli di HbA1c come riflesso alla riduzione di IR [8, 9].
A livello di tessuto adiposo, la vit. D può ridurre lo stato infiammatorio. Sebbene fegato e reni siano i più ampiamente riconosciuti siti del metabolismo della vit. D, anche gli adipociti possiedono la capacità di metabolizzarla. Molti studi in vitro che utilizzano linee cellulari umane di preadipociti sottocutanei e cellule staminali mesenchimali hanno dimostrato, infatti, che la vit. D modula la differenziazione dei preadipociti in adipociti maturi e agisce a diversi livelli per modulare l’infiammazione adiposa [10].
Per quanto riguarda il tessuto muscolare, sappiamo nella fase post-prandiale, esso smaltisce il 70-90% del glucosio circolante, e che livelli adeguati di vit. D sono coinvolti nel miglioramento di questo meccanismo muscolare [11, 12, 13].
E’ stato dimostrato che la carenza di vit. D può essere coinvolta nelle complicanze microvascolari e macrovascolari, come la retinopatia diabetica e l’aterosclerosi periferica e carotidea. L’effetto diretto della vit. D sul tono vascolare riduce inoltre l’afflusso di calcio ai vari tessuti [14,15].
Il livello di vit. D è inoltre legato in modo inverso alla pressione arteriosa. Un importante studio del 2021 suggerisce che i livelli sierici di vit. D sono indipendentemente associati a valori di pressione arteriosa alta e al rischio di ipertensione incidente in una popolazione di mezza età . Oltre alla correlazione negativa tra livelli di vit. D e pressione arteriosa in soggetti non ipertesi, lo sviluppo di ipertensione in pazienti con pressione arteriosa normale in un follow-up di 8 anni è un risultato sorprendente [16]. Tuttavia saranno necessari ulteriori studi di popolazione con un ampio numero di pazienti per valutare il ruolo dell’integrazione e/o dei livelli sierici di vit. D nel prevenire o ritardare lo sviluppo di ipertensione nei pazienti pre-ipertesi.
Uno studio più datato suggerisce che le proprietà antipertensive e protettive dei metaboliti della vit. D sono da attribuire all’inibizione della sintesi della renina da parte della 1,25(OH)2D nel rene [17].
Vit. D e diabete mellito di tipo 1 (DMT1)
Il DMT1 è una patologia autoimmune in cui il sistema immunitario distrugge le beta-cellule del pancreas che producono insulina, portando a una carenza o assenza di questo ormone. La prevalenza di questa patologia è aumentata progressivamente negli ultimi decenni nella maggior parte dei paesi (dai un’occhiata all’epidemiologia).
Le conoscenze attuali indicano che la vit. D potrebbe avere un ruolo positivo nella prevenzione di altre patologie autoimmuni concomitanti e di complicanze gravi. Essa infatti svolge una funzione importante nello sviluppo dell’autotolleranza. Questa relazione è dovuta alla presenza di recettori VDR in tutto il corpo e l coinvolgimento della vit. D nella modulazione dello stato infiammatorio: tala scoperta ha notevolmente ampliato gli studi sugli effetti extra-scheletrici di questa sostanza [18]. Si tratta infatti di una caratteristica molto interessante nel caso del DMT1, in quanto nel pancreas di pazienti affetti da questa patologia è presente un infiltrato infiammatorio composto da linfociti T e B e da macrofagi, cellule bersaglio della vit. D. E’ stato visto che nei modelli animali di DMT1 alte dosi di vit. D contengono e arrestano la progressione infiammatoria, come indicato dalla riduzione quantitativa di linfociti T effettrici e l’attivazione di cell. T regolatrici [19, 20, 21].
Vit. D e diabete mellito gestazionale (DMG)
Il DMG è la condizione clinica più frequente in gravidanza ed è caratterizzato da una intolleranza al glucosio con iperglicemia (qui trovi una descrizione completa e accessibile anche ai non addetti ai lavori).
Una delle modificazioni fisiologiche in gravidanza riguarda proprio il metabolismo della vit. D: i suoi livelli aumentano all’inizio della gravidanza e raggiungono i valori più alti nel terzo trimestre (2-3 volte maggiori rispetto allo stato pre-gravidico) [22]. Tra i fattori che possono svolgere un ruolo nell’insorgenza del DMG vi è l’infiammazione cronica di basso grado [23, 24]: in questo contesto può agire positivamente un buon livello di vit. D . E’ stato visto che bassi livelli di vit. D innescano risposte infiammatorie attraverso la via del nuclear factor kappa-light-chain-enhancer of activated B cells (NF-kB), un complesso proteico che agisce come fattore di trascrizione, fondamentale per la risposta delle cellule a stimoli come infiammazione, infezioni, stress e danni cellulari. Inoltre, bassi livelli di vit. D sono legati a un aumento della specie reattive dell’ossigeno (ROS) nelle beta-cellule pancreatiche che ne provocano la morte [25].
In questo processo infiammatorio sono coinvolti anche alcuni geni protettivi inattivati dal processo di ipermetilazione. E’ stato dimostrato che la vit. D è protettiva nei confronti di queste modificazioni genetiche [26], oltre che nei confronti dell’eccessivo aumento di peso [27], altro fattore di rischio per DMG.
Una interessante metanalisi fa il punto sugli studi condotti negli ultimi anni riguardo agli effetti dell’integrazione di vit. D in gravidanza, sottolineando come questa migliori i livelli di lipidi nel sangue di pazienti con diabete gestazionale e riduca gli esiti avversi nei neonati [28]. Questi dati sono in accordo con numerosi studi precedenti [29].
(Per una lettura tecnica su classificazione e diagnosi di DM, puoi leggere questo)
Vit. D e sindrome metabolica (MetS) e malattie cardiovascolari (CV)
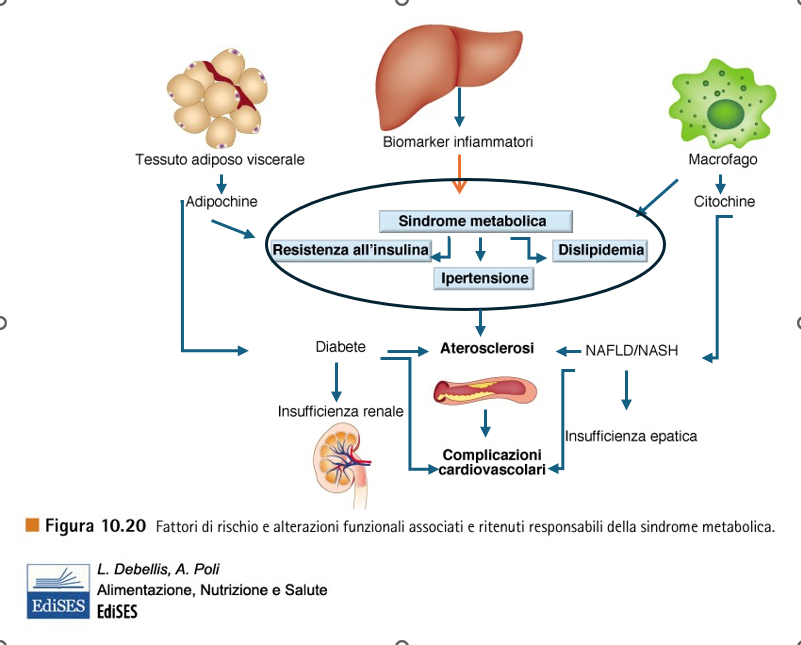
(immagine modificata)
Secondo la recente definizione dell’OMS, del National Cholesterol Education Program (NCEP) Adult Tratment Panel III (ATP III) e dell’Internatione Diabetes Federation (IDF), con il termine Sindrome Metabolica si indica un insieme di alterazioni anatomiche e biochimiche caratteristiche: aumento della circonferenza vita, aumento dei trigliceridi, bassi livelli di colesterolo HDL, elevata glicemia, elevata pressione arteriosa ([30]. Gli individui che mostrano queste caratteristiche sono ad alto rischio di contrarre malattie cardiovascolari e DMT2.
E’ stato visto che la carenza di vit. D è un fattore di rischio per la MetS [31], in quanto, in ragione dell’ubiquità dei recettori VDR, la sua presenza induce protezione ossidativa attraverso sistemi antiossidanti come la glutatione perossidasi e la superossido dismutasi, oltre che attraverso l’inibizioni di specie reattive dell’ossigeno [32, 33]. Inoltre, la vit. D risulta essere un regolatore trascrizionale diretto della sintesi endoteliale di ossido nitrico (NO) [molecola con funzioni anti-trombolitiche, anti-infiammatorie, protegge dall’aggregazione piastrinica e dall’adesione dei globuli bianchi alle pareti vascolari, prevenendo la formazione di coaguli e l’aterosclerosi] [34]. Nonostante l’associazione fra livelli di vit. D e MetS sia controversa per la mancanza di studi longitudinali prospettici, vi sono sufficienti studi per considerare i benefici di una integrazione di vit. D [35, 36, 37].
I meccanismi che sottostanno a questa correlazione potrebbero essere diversi, alcuni dei quali già accennati, come la correlazione inversa fra livelli circolanti di vit. D e obesità addominale (con conseguente aumento di citochine infiammatorie). Poiché questo pre-ormone è liposolubile e viene sequestrato-immagazzinato nel grasso di riserva, è intuitivo che le persone con sovrappeso e obesità abbiano bassi livelli circolanti di vit. D.
In sintesi, ecco cosa ricordare rispetto al ruolo della vit. D nella MetS:
1) protezione antiinfiammatoria endoteliale;
2) modulazione dell’IR e protezione dal DMT2 e DMG;
3) effetto ipotensivo;
4) prevenzione dell’ipoparatiroidismo;
5) aumento della lipolisi e inibizione della lipogenesi.
Molti studi indicano che l’integrazione di vit. D ha effetti positivi su diversi aspetti della MetS: in particolare sul miglioramento del profilo lipidico, sulla IR, sulla proteina C reattiva (PCR), sulla modulazione della glicemia a digiuno.
Qui troverai una tabella relativa agli studi sull’integrazione e i suoi effetti sulle patologie analizzate. Queste invece sono le ultime linee guida relative all’integrazione per prevenire l’oseoporosi; dai anche un’occhiata alle raccomandazioni relative all’assunzione nelle varie fasce d’età.
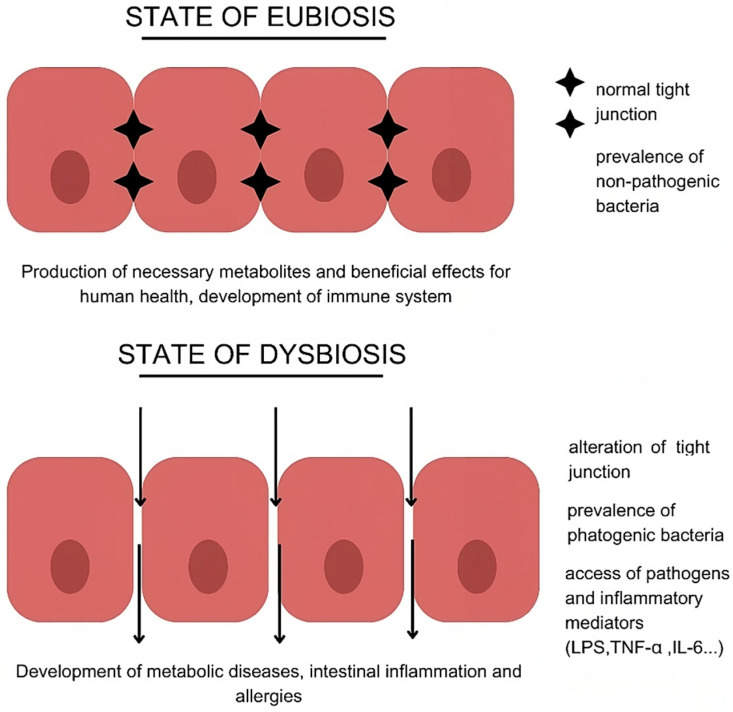
Per completezza, mi sembra importante aggiungere un’altra tessera a questo mosaico così interessante e complesso. Una quantità crescente di studi ha valutato gli effetti della vitamina D sul microbiota intestinale soprattutto nel campo delle malattie infiammatorie croniche intestinali (MICI), condizioni multifattoriali in cui la disbiosi gioca un ruolo di primo piano nell’innesco e mantenimento delle lesioni [38]. Bassi livelli di vit. D in pazienti affetti da queste patologie e, soprattutto, la relazione dei livelli sierici con l’attività di malattia, il rischio di recidiva, le risposte alle terapie o il loro fallimento alle terapie hanno determinato un crescente interesse sul possibile ruolo nella patogenesi delle MICI. Studi su modelli sperimentali suggeriscono da una parte che modifiche epigenetiche indotte dall’infiammazione intestinale possano ridurre l’espressione del gene codificante il recettore nucleare della vitamina D [39] e, dall’altra, che la via di segnale vit. D/VDR possa regolare diversi fattori coinvolti nell’infiammazione intestinale [40, 41]. In particolare, la vit. D sembrerebbe influenzare l’integrità della barriera intestinale modulando l’espressione di componenti delle giunzioni strette e aderenti e favorendo il rilascio di peptidi antimicrobici (catelicidine, beta-defensine) da parte delle cellule di Paneth e di mucine, esercitando un effetto immunomodulante sia inibendo il rilascio di citochine pro-infiammatorie, sia favorendo il rilascio di quelle antinfiammatorie e l’induzione di linfociti T regolatori [42].
Importante è anche la relazione inversa, cioè l’effetto che la somministrazione di probiotici può produrre sull’assorbimento e quindi sulla disponibilità della vitamina D. Un chiaro esempio è fornito dal miglioramento degli assorbimenti nella contaminazione batterica dell’intestino tenue in cui per cause diverse si verifica una sovraccrescita/contaminazione della flora intestinale per via discendente o ascendente. Le cause più comuni sono: l’insufficiente secrezione di succo gastrica (da terapia cronica con prazoli, da gastrite atrofica autoimmune o da interventi chirurgici), le alterazioni della motilità (soprattutto in corso di diabete, malattie autoimmuni sistemiche come la sclerodermia, diverticolosi, stenosi, by-pass intestinali) e della valvola ileo-ciecale (da malattia di Crohn o interventi chirurgici) [43].
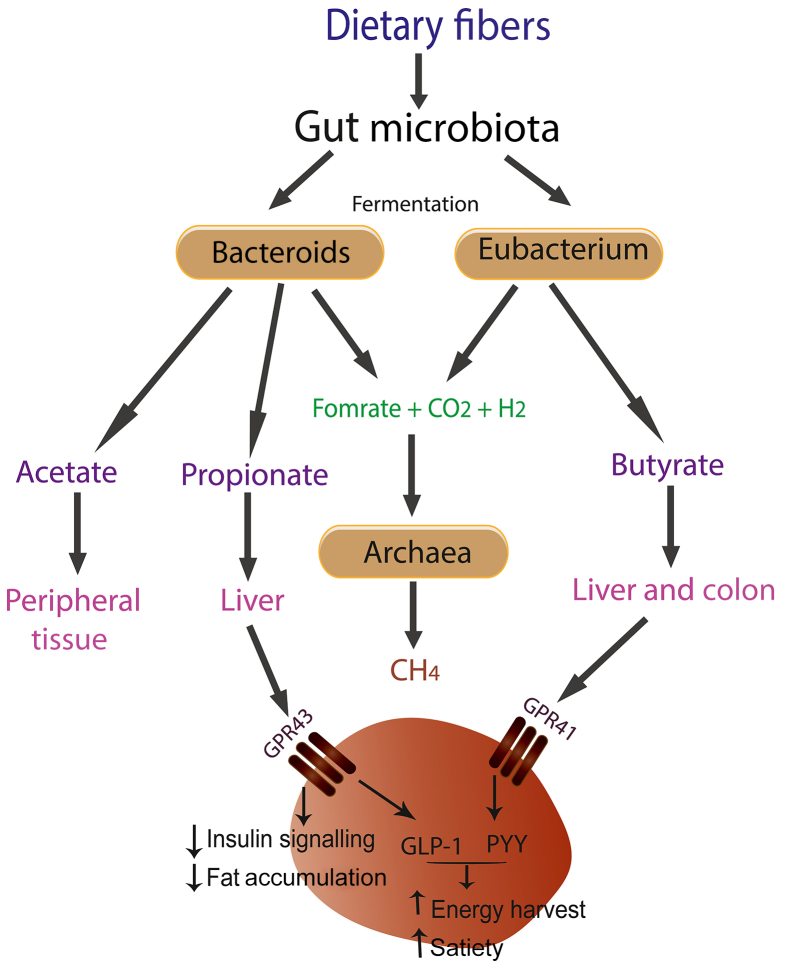
Formazione di ac. grassi a catena corta, fra cui il butirrato. Fonte: https://pubmed.ncbi.nlm.nih.gov/37422149
Tuttavia esistono ancora poche evidenze relative all’utilità dell’ntegrazione probiotica in questo contesto [44, 45, 46, 47].
Vale la pena sottolineare la possibile interazione funzionale tra microbiota residente e/o probiotici e il VDR. In modelli animali di colite, infatti, l’azione antinfiammatoria del butirrato potrebbe essere connessa all’aumentata espressione genica del VDR indotta dallo stesso composto [48].
Conclusioni
La corposa mole di studi e dati derivati indica l’importanza del ruolo protettivo della vit. D nell’eziogenesi di patologie metaboliche, autoimmuni e intestinali. Le sue funzioni extra-scheletriche sono ben documentate da tempo, pertanto il monitoraggio e l’eventuale integrazione sono ritenuti indispensabili al fine di migliorare sia la salute scheletrica che quella metabolica e prevenire patologie connesse alla carenza vitaminica D.
Potrebbe interessarti anche Nutrizione e infiammazione in menopausa

 Uno degli argomenti che ha attirato maggiormente la mia attenzione negli ultimi anni è il legame fra stato nutrizionale e patologie della donna. E poiché la
Uno degli argomenti che ha attirato maggiormente la mia attenzione negli ultimi anni è il legame fra stato nutrizionale e patologie della donna. E poiché la  Ultracorpi di Francesca Marzia Esposito (minimum fax, 2024) è un saggio narrativo sulla ricerca della perfezione corporea. L’autrice ne parla attraverso una scrittura superba e intrecciando approfondimenti su fatti e personaggi a racconti autobiografici .
Ultracorpi di Francesca Marzia Esposito (minimum fax, 2024) è un saggio narrativo sulla ricerca della perfezione corporea. L’autrice ne parla attraverso una scrittura superba e intrecciando approfondimenti su fatti e personaggi a racconti autobiografici . involgimento dei genitori
involgimento dei genitori La recente rilettura del saggio di
La recente rilettura del saggio di 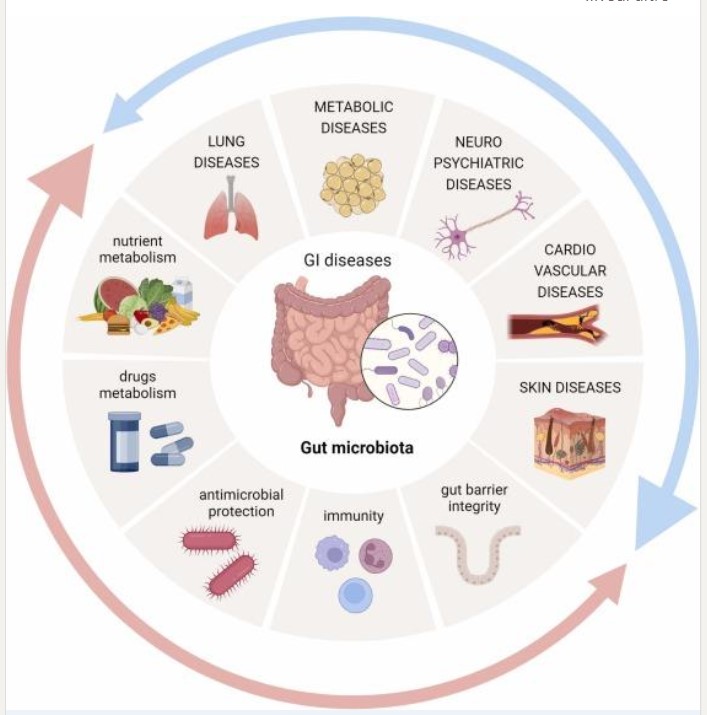


 Il terzo e ultimo incontro sarà incentrato sugli strumenti necessari a strutturare il percorso genitoriale, parallelo e complementare a quello dedicato al bambino. Dal linguaggio da adottare in famiglia alle modalità di contenimento di eventuali fallimenti e alla valorizzazione degli obiettivi raggiunti, verranno affrontati i modi possibili con i quali inserire nel percorso riabilitativo del bambini la presenza attiva e incoraggiante degli adulti di riferimento.
Il terzo e ultimo incontro sarà incentrato sugli strumenti necessari a strutturare il percorso genitoriale, parallelo e complementare a quello dedicato al bambino. Dal linguaggio da adottare in famiglia alle modalità di contenimento di eventuali fallimenti e alla valorizzazione degli obiettivi raggiunti, verranno affrontati i modi possibili con i quali inserire nel percorso riabilitativo del bambini la presenza attiva e incoraggiante degli adulti di riferimento. All’inizio dell’estate, ho letto Social Fame, Adolescenza, social media e disturbi alimentari di Laura Dalla Ragione e Raffaella Vanzetta, pubblicato da
All’inizio dell’estate, ho letto Social Fame, Adolescenza, social media e disturbi alimentari di Laura Dalla Ragione e Raffaella Vanzetta, pubblicato da 