Negli ultimi dieci anni la mia attenzione e il mio interesse alla relazioni ecologia batterica-salute umana si sono arricchiti di uno sguardo più ampio verso altri equilibri e relazioni in apparenza lontanissimi eppure così strettamente legati alla nostra salute da non poterne prescindere. Studiando le conseguenze della perdita della biodiversità nelle varie nicchie ecologiche della Terra, appaiono ovvie e meravigliose la misura e la modalità con cui ogni sistema si tiene, si lega e si influenza reciprocamente. E come l’attività antropica influisce su questa meraviglia. Se gli equilibri biologici ambientali delle foreste e degli oceani vengono modificati dalle attività umane, la qualità della nostra vita non può che peggiorare.
Gli aspetti più preoccupanti sono la lentezza con cui i governi si attivano in direzione eco-correttiva e il crescente negazionismo che ogni giorno pervade i contesti di comunicazione e informazione. Mentre ne scrivo, mi sento inutile, disarmata, impotente, pur sapendo quanto valore abbia l’impegno individuale nei contesti in cui si può metterlo in pratica. Il mio contesto, con i miei minuscoli mezzi e la mia piccola testa, è lo studio, la pratica ambulatoriale, la divulgazione di informazioni e contenuti. Ma la frustrazione nel farlo è un sentimento inevitabile, tanto la tenacia nel continuare a farlo. Ecco dunque, un altro piccolo pezzo di strada che vorrei condividere con chi legge.
Questo contributo non ha la pretesa di aggiungere valore ad argomenti così innegabilmente validi e importanti, ma semmai di mantenere alte curiosità e attenzione in chi, come me, lavora nel capo sanitario. La speranza è quella di essere in tanti, sempre di più, di condividere informazioni e dati utili a lavorare meglio e nella direzione giusta. Qual è la direzione giusta? Io credo, sia agire con i propri strumenti nel rispetto degli equilibri biologici umani, sapendo che non sono gli unici importanti, ma che al contrario dipendono profondamente dal resto dei sistemi e dei contesti ambientali. Ricostruire, ristabilire, ripristinare, in una parola prevenire ciò che possiamo prevenire e trattare come si può ciò che va trattato.
Ma eccoci ai nostri assi, alla nostra meravigliosa realtà biologica, il nostro patrimonio di biodiversità e complessità da cui partire per un percorso di approfondimento e considerazioni sempre più ampie e integrate.
Qualche anno fa, un gruppo di ricercatori guidati dalll’Università di Bologna, ha individuando, attraverso l’analisi del DNA presente in resti fecali risalenti a circa 50.000 anni fa (Uomo di Neanderthal), microrganismi che ancora oggi ritroviamo nell’intestino dell’uomo moderno. Se ci pensiamo, è una scoperta straordinaria che ci avvicina ai nostri lontanissimi progenitori e che ci pone di fronte a una realtà inconfutabile: l’evoluzione ha avvantaggiato alcune popolazioni microbiche intestinali piuttosto che altre e ne ha conservato la biodiversità. Si tratta di ceppi batterici ancestrali con cui nasciamo; batteri pionieri, come li definisce Vassilios Fanos, ordinario dell’Università di Cagliari, studioso di Microbiota e Metabolomica (la scienza che si occupa di metaboliti derivati dai processi cellulari).
La descrizione di uno dei suoi testi più noti (I batteri pionieri pilastri della salute. Gravidanza, nascita, allattamento e crescita tra microbiomica e metabolomica), spiega molto bene l’importanza di conoscere i meccanismi che regolano la relazione fra il corpo umano e i microrganismi che lo popolano: “I batteri, attraverso i metaboliti, dialogano tra di loro, con le singole cellule e con tutti i nostri organi, dal cervello alla bocca, dal polmone alla cute, li orientano e li controllano. La metabolomica ci consente di decifrare queste comunicazioni, che rappresentano il linguaggio segreto del nostro corpo. I veri protagonisti, nella creazione di queste reti di relazioni, sono i batteri pionieri, quelli che per primi, alla nascita, colonizzano i distretti corporei. La conoscenza di queste reti può aiutarci a comprendere meglio le malattie, a curarle e a prevenirle in modo personalizzato. Esiste uno stretto rapporto tra microbiota e alimentazione, quando mangiamo nutriamo anche il nostro microbiota”.
 La recente rilettura del saggio di Martin J. Blaser, Che fine hanno fatto i nostri microbi? Come l’abuso di antibiotici aumenta le malattie della nostra epoca (Aboca Edizioni), mi porta ad aggiungere un’ulteriore considerazione a quelle di Fanos: e cioè che lo scardinamento di equilibri biologici ancestrali a causa della scomparsa di ceppi microbici ben selezionati e integrati nelle nicchie biologiche umane non fa che renderci sempre più vulnerabili alle malattie. Negli ultimi dieci anni questa fragilità si configura non solo attraverso la resistenza antibiotica di certi batteri patogeni e come conseguente disfunzionalità dei nostri sistemi (immunitario, endocrino, renale, cardiocircolatorio e metabolico) che risultano così maggiormente predisposti alle malattie. Dagli anni settanta a oggi, Blaser ha studiato la relazione fra lle variazioni dell’ecologia di specifici ceppi batterici e l’aumento di incidenza di alcune patologie, fra cui il diabete mellito di tipo 1 e l’obesità giovanile.
La recente rilettura del saggio di Martin J. Blaser, Che fine hanno fatto i nostri microbi? Come l’abuso di antibiotici aumenta le malattie della nostra epoca (Aboca Edizioni), mi porta ad aggiungere un’ulteriore considerazione a quelle di Fanos: e cioè che lo scardinamento di equilibri biologici ancestrali a causa della scomparsa di ceppi microbici ben selezionati e integrati nelle nicchie biologiche umane non fa che renderci sempre più vulnerabili alle malattie. Negli ultimi dieci anni questa fragilità si configura non solo attraverso la resistenza antibiotica di certi batteri patogeni e come conseguente disfunzionalità dei nostri sistemi (immunitario, endocrino, renale, cardiocircolatorio e metabolico) che risultano così maggiormente predisposti alle malattie. Dagli anni settanta a oggi, Blaser ha studiato la relazione fra lle variazioni dell’ecologia di specifici ceppi batterici e l’aumento di incidenza di alcune patologie, fra cui il diabete mellito di tipo 1 e l’obesità giovanile.
Torniamo all’intestino. Oggi sappiamo che il microbiota intestinale è coinvolto in importanti funzioni metaboliche, di protezione, di sintesi e che influenza le azioni di diversi organi, come il cervello, il tessuto adiposo, il pancreas endocrino e il muscolo scheletrico.
Ne consegue che chi si occupa di salute deve considerare l’organismo umano in tutta la sua complessità e biodiversità con particolare attenzione agli assi microbiotici. Vediamoli in sintesi.
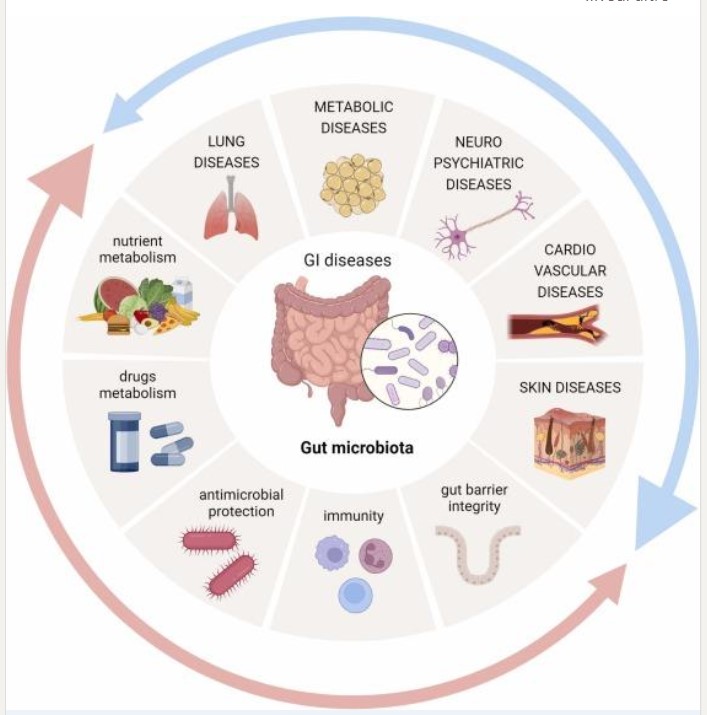
Fonte: Impact of gut microbial dysbiosis in human diseases (Shinga et al. 2023)
Asse intestino-cervello
Che tra il microbioma intestinale umano e il cervello vi sia un asse funzionale con cui i due sistemi (gastrointestinale e neurologico) comunicano e si influenzano reciprocamente è noto da molti anni. Così com’è nota l’importanza degli strumenti nutrizionali, dei probiotici e dei prebiotici come supporto al buon funzionamento dell’asse intestino-cervello.
Sappiamo da tempo che i lipopolisaccaridi batterici forniscono una stimolazione tonica di basso grado del sistema immunitario innato e che una stimolazione eccessiva dovuta a disbiosi batterica, con conseguente permeabilità intestinale, può produrre un’infiammazione del sistema nervoso sistemico e/o centrale. Gli enzimi batterici, inoltre, possono produrre metaboliti neurotossici come l’acido D-lattico e l’ammoniaca. D’altra parte, i microbi intestinali, in stato di eubiosi o di disbiosi, sono in grado di produrre ormoni e neurotrasmettitori identici a quelli umani, influenzando così la risposta immunitaria. Attraverso questi e altri meccanismi, molti dei quali mediati dal nervo vago, il microbiota intestinale modula il sonno e la risposta allo stress, l’attività dell’asse ipotalamo-ipofisi-surrene. L’asse intestino-cervello è in grado inoltre di influenzare la memoria, l’umore e la concentrazione.
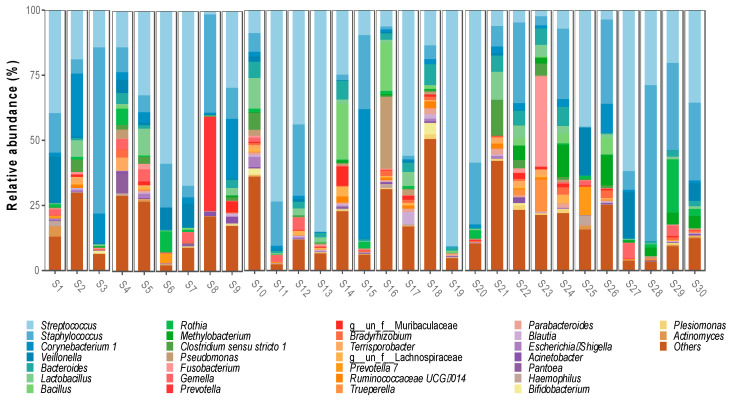
Generi batterici identificati nel microbiota del latte materno (Londono-Sierra et al. 2023)
Asse microbiota mamma-bambino
Esistono prove sempre più evidenti che la dieta, lo stato nutrizionale delle donne durante la gravidanza e la composizione microbica del latte materno possono modulare il microbiota intestinale del neonato. Si stima infatti che circa il 25-30% del microbiota infantile abbia origine nel latte materno, il cui microbiota centrale è composto da nove generi (specie diverse di Staphylococcus, Streptococcus, Serratia, Pseudomonas, Corynebacterium, Ralstonia, Propionibacterium, Sphingomonas e Bradyrhizobium).
Sappiamo già da qualche anno che la genetica dell’ospite (nutrice), l’ambiente prenatale e la modalità di parto possono modellare il microbioma del neonato alla nascita. E che in seguito, fattori postnatali come il trattamento antibiotico, la dieta o l’esposizione ambientale, modulano ulteriormente lo sviluppo del microbioma e del sistema immunitario del neonato, proteggendolo oppure esponendolo a patologie di vario tipo. Diventa importante, dunque, comprendere la composizione del microbioma nelle prime fasi della vita.
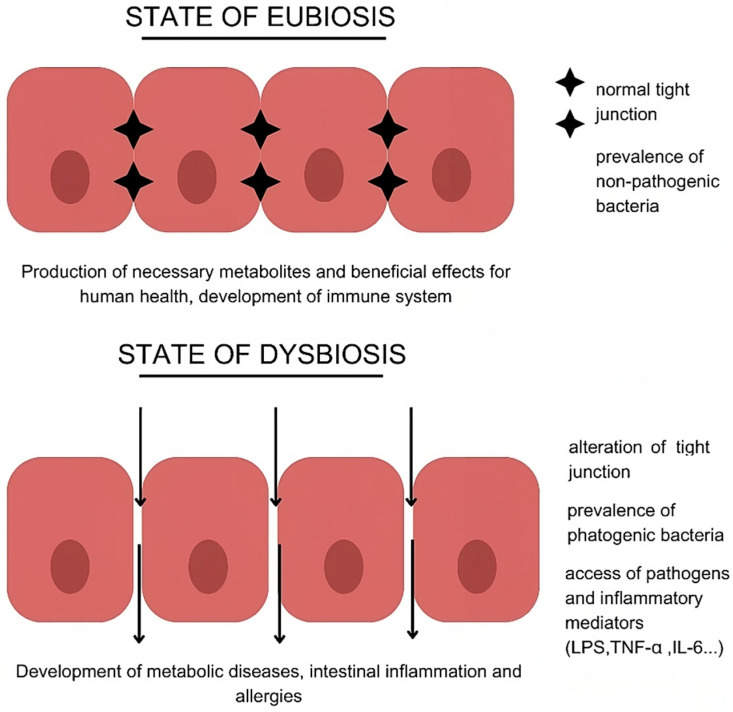
Rappresentazione dell’eubiosi e della disbiosi e dei relativi effetti e conseguenze. Fonte: Myokines and Microbiota: New Perspectives in the Endocrine Muscle–Gut Axis. Saponaro. F. et al, Nutrients, 2024
Asse intestino-muscolo
Gli studi sulla modalità con cui i microrganismi del microbiota intestinale riescono a modificare la quantità e la qualità della massa muscolare, i processi anabolici e catabolici e le funzioni del muscolo scheletrico, sono sempre più numerosi e sempre più interessanti. Essi rivelano anche che il microbiota intestinale è a sua volta modificato dal muscolo. Sembra dunque che il microbiota intestinale possa influenzare (in maniera positiva o negativa) la massa e la funzione muscolare regolando il metabolismo delle sostanze e dell’energia, la sensibilità all’insulina, l’infiammazione, l’immunità sistemica e la produzione di miochine.
Di recente ho partecipato alla pubblicazione su Nutrients di una review che spero renda più chiaro questo equilibrio così complesso. Il testo è consultabile gratuitamente.
Asse intestino-vagina-vescica
Il microbiota vaginale umano comprende una vasta gamma di microrganismi benefici (soprattutto Lattobacilli) e agenti patogeni opportunistici. Per studiare il microbiota vaginale sono stati sviluppati molteplici approcci che coinvolgono le tecnologie “-omiche”. L’integrazione dei dati provenienti dalle scienze “-omiche” permette di decifrare informazioni funzionali provenienti da comunità microbiche complesse attraverso l’associazione di profili batterici e metabolici. La disbiosi vaginale è spesso associata a diverse malattie ginecologiche (ad esempio vaginosi batterica, candidosi vulvovaginale, infezioni da Clamidia) e urologiche (cistiti recidivanti). Negli ultimi dieci anni le indagini sul microbiota vaginale sono aumentate in modo esponenziale. Questi studi hanno rivelato che la composizione microbica vaginale è in stretta relazione con quella intestinale e che l’asse intestino-distretto vaginale influenza anche la salute delle vie urinarie.
Asse intestino-fegato
In condizioni fisiologiche microbiota intestinale e fegato costituiscono un asse protettivo a difesa dell’organismo. In particolare, questo asse ha un ruolo fondamentale nel prevenire l’infiammazione sistemica: l’integrità della barriera intestinale permette il passaggio di una piccola quantità di prodotti pro-infiammatori batterici e xenobiotici. Questi attraverso la vena porta giungono al fegato dove vengono neutralizzati, prevenendo così l’infiammazione sistemica.
La rottura del delicato equilibrio tra fattori pro-infiammatori e meccanismi di tolleranza provoca una sovracrescita batterica, la disbiosi intestinale e la maggiore permeabilità della barriera intestinale. Ciò induce una risposta immunitaria disfunzionale che alimenta e amplifica l’infiammazione epatica e sistemica.
La complessità di questi sistemi deve indurci a riflettere. Cambiamenti profondi nell’ecologia batterica umana, come quelli indotti dalla resistenza agli antibiotici e dalla diffusione di inquinanti e interferenti endocrini attraverso l’acqua e gli alimenti, influenzano gli equilibri selezionati dall’evoluzione, insieme a quelli animali, vegetali, batterici, attraverso i millenni. Dall’infinitamente piccolo all’inimmaginabile grande, tutto ci imbriglia in una rete di relazioni strettissime e complesse che risentono di ogni cambiamento climatico, di ogni estinzione o sovra-popolamento. Le catene alimentari di tutto il pianeta ci coinvolgono e ci riguardano da vicino; così come gli adattamenti degli altri esseri viventi di nicchie ecologiche terrestri e marine, vicine o lontanissime che siano.
Questo, credo, sia la direzione giusta verso cui guardare, verso cui continuare a muoversi, in scienza e coscienza. Vi aspetto qui per i prossimi passi.
Per approfondire
- I batteri pionieri pilastri della salute. Gravidanza, nascita, allattamento e crescita tra microbiomica e metabolomica. Vassilios Fanos
- Vaginal microbiota and the potential of Lactobacillus derivatives in maintaining vaginal health
- Maternal Diet May Modulate Breast Milk Microbiota—A Case Study in a Group of Colombian Women
- The gut microbiome and the brain
- Gut microbiome associated dysbiosis: Limited regimens and expanding horizons of phage therapy